אחת לשבועיים הצטיידו שתי חוקרות במזרק גדוש בחומר שנרקח מבעוד מועד, והרחיקו לחווה הממוקמת אי שם במעבה הנגב הצפוני. שם חיכתה להן נאקה העונה לשם ציפורה, שברגע שהבחינה בהן, ידעה שהנה מתקרבת הארוחה הדשנה שזכרה מהפעם הקודמת. היא נכנסה על דבשתה לתוך חדר סטרילי, ובזמן שנהנתה ממנת גורמה המונחת בדלי, מחט דקיקה הוחדרה לגופה. עשרים שניות נמשך כל האירוע, ובסיומו חזרה ציפורה אל אחיה הגמלים ושכחה מכל העניין. מי שלא שכחה היא מערכת החיסון שלה, שפגשה בחומר מהמזרק ומיד עשתה את מלאכתה. ספק אם הנאקה ציפורה ידעה שבזמן שהיא מבלה עם חבריה, היא גם תורמת למאבק במחלת הסרטן.
"לפני שהתחלנו את העבודה קראנו לנאקה 'מנחם', כי חשבנו שזה גמל. כשהבנו שלא מדובר בזכר, עברנו לשם המקורי שהעניקו לה בחווה", צוחקת ליאור רוזנפלד – היום ד"ר ליאור רוזנפלד הודות לאותו מחקר. "הזרקנו לה חלבון מיוחד, שאותו הרחפנו בתמיסה שמעוררת את מערכת החיסון, ודומה לתמיסה בחיסונים שאנחנו בני האדם מקבלים. מכיוון שהחומר צמיגי מאוד, השתמשנו במזרק מגניב וייחודי שמאפשר לערבב אותו. פעם בשבועיים, במשך 16 שבועות, ארגנו הכול, עלינו לרכב ויצאנו לחווה. אני מוכרחה לומר שהיה נראה שהנאקה אפילו לא מרגישה את הזריקה. אנחנו מדברים על חיה ששוקלת כמה מאות קילוגרמים, ומחדירים לה מחט כמו זו שמוכרת לנו".
בדומה למקבלי חיסון הקורונה בישראל, גם מערכת החיסון של ציפורה פגשה מעטפת חלבון שאינה מזיקה לה. ובדומה לבדיקה הסרולוגית המוכרת, גם מהנאקה נלקחו דגימות דם שסיפקו לחוקרים מידע על מצב הנוגדנים בגופה. דגימה אחת נלקחה אחרי חודשיים, והשנייה בתום התקופה של 16 השבועות. המבחנות עמוסות הנוגדנים הובאו למכון הלאומי לביוטכנולוגיה (NIBN) באוניברסיטת בן־גוריון, למעבדה של פרופ' ניב פפו, מי שעומד מאחורי המחקר המבטיח. אז במשך תקופה ארוכה ישבה רוזנפלד ודאגה לשלוף מתוך 10 מיליוני נוגדנים את אלה שעשויים לשאת בשורה עבור חולי סרטן הערמונית, ולחולל מהפכה באבחון ובטיפול במחלה.
פרופ' ניב פפו: "הרעיון היה לייצר נוגדן קטן מספיק, על מנת שיוכל לחדור את המסה של גידול סרטני ולהיכנס פנימה לתוך התאים עצמם. אנחנו גם רוצים שהוא יתפנה מהגוף במהירות, ואִילו חומרים 'גדולים' נוטים להישאר בדם למשך הרבה מאוד זמן. עשינו סיעור מוחות, ואז עלה הרעיון: הגמלים שאנחנו רואים בדרך לכאן, הם ייצרו לנו ננו־נוגדנים"
יש משמעות לעובדה שציפורה היא דווקא נקבה?
"לא, אין לזה כל משמעות", אומרת רוזנפלד. "אנחנו חוקרים מנגנון שמשותף לכל משפחת הגמליים – גמלים, למות, אלפקות ועוד מינים מוכרים פחות. לצד נוגדנים הדומים לאלה שלנו, בני המשפחה הזו מייצרים נוגדנים מיוחדים, שאנחנו יכולים להנדס אותם לכעשירית מגודלם של נוגדנים אנושיים בלי לפגוע בתפקודם. כך יש בידינו מה שאנו מכנים ננו־נוגדנים, Nanobodies. אגב, גם לכרישים יש מנגנון דומה, אבל הגמליים דומים יותר לנו. ממה שאנחנו הצלחנו לאבחן – ועדיין לא ביססנו סטטיסטית – נראה שהנוגדנים הייחודיים קיימים אצל גמלים יותר מאשר בלמות ואלפקות, החיות שרוב החוקרים בעולם משתמשים בהן במחקרים כאלה. אנחנו גרים במזרח התיכון, עובדים בנגב, ויש לנו כאן בעל חיים שייחודי לנו וזמין לנו, אז אנחנו מקווים שמכאן תצא הבשורה".

לחולי פרקינסון ואלצהיימר.
פרופ' פפו. צילום: לירון מולדובן
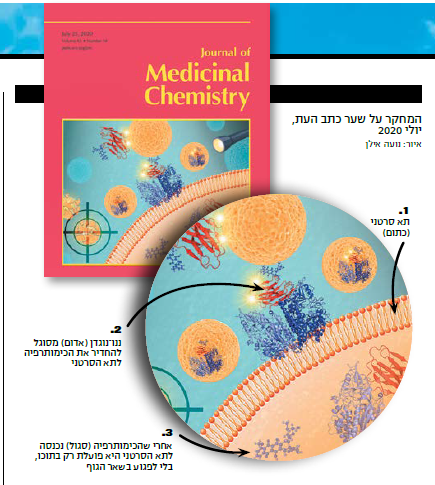
לא בכדי כיכב המחקר על שער כתב־העת המדעי Journal of Medicinal Chemistry, בסוף יולי 2020. השער, שאותו בנתה רוזנפלד יחד עם מעצבת גרפית, מדגים מה מעוללים הנוגדנים שהוצאו מגוף הנאקה לתאים סרטניים. המחקר זכה לכותרות רבות, ובימים אלה שב לשיח המדעי בעקבות משא ומתן מתקדם בין המכון לבין חברת תרופות אמריקנית, במטרה להגיע לפיתוח תרופה וכלי אבחון לסרטן הערמונית.
שני גמלים חולפים על פניי כשאני מדרימה למחלקה להנדסת ביוטכנולוגיה ע"ש אברהם וסטלה גולדשטיין־גורן באוניברסיטה הבאר־שבעית. נראה שהם חלפו גם על פניו של פרופ' פפו (49), שמגיע לכאן מביתו בשרון. "אנחנו עובדים בנגב, יש לנו גמלים זמינים, ואין לנו תחרות מצד המדינות השכנות", הוא אומר כשאנחנו יושבים במעבדה שלו. "בתחום הנוגדנים יש תחרות גדולה מאוד, וכניסה לעבודה כזו פירושה לקיחת סיכון. לחברות התרופות יש הרבה יותר משאבים מאיתנו, וקשה לנו להתחרות בהן. אם אנחנו רוצים להתחיל לייצר נוגדנים למחלות מסוימות, החברות הגדולות תמיד יובילו. לכן אנחנו צריכים לבוא עם נוגדן מיוחד, לא רגיל.
ד"ר ליאור רוזנפלד: "בהתחלה קראנו לנאקה 'מנחם', כי חשבנו שזה גמל. פעם בשבועיים, במשך 16 שבועות, ארגנו הכול, עלינו לרכב ויצאנו לחווה. אני מוכרחה לומר שהיה נראה שהנאקה אפילו לא מרגישה את הזריקה"
"במקרה שלנו הרעיון היה לייצר נוגדן קטן מספיק על מנת שיוכל לחדור את המסה של גידול סרטני ולהיכנס פנימה לתוך התאים עצמם. אנחנו גם רוצים שהוא יתפנה מהגוף במהירות, ואִילו חומרים 'גדולים' נוטים להישאר בדם למשך הרבה מאוד זמן. כשישבתי עם ליאור במעבדה ועשינו סיעור מוחות לגבי נושא הדוקטורט שלה, עלה הרעיון: הגמלים שאנחנו רואים בדרך, הם ייצרו לנו ננו־נוגדנים".
איך גילו בכלל שלגמלים יש נוגדנים ייחודיים כאלה?
"בשנות השמונים הייתה בבלגיה קבוצה של סטודנטים שחקרה זיהום מים בסביבה של גמלים, ורצתה להבין מה מקור הזיהום. הם לקחו דם של גמל ששתה את המים, ואז הבחינו שאת הנוגדנים שהוא ייצר אפשר 'לפרק' ולהקטין. על הנתון הזה הם עלו לגמרי במקרה. אותם סטודנטים בשנות השמונים לא חשבו שבעזרת הננו־נוגדנים נוכל לייצר תרופות לסרטן בשנות האלפיים. זה היופי במחקר – אתה מפרסם משהו שגילית וכך אתה עוזר למי שבא אחריך, גם אם אתה לא יודע את זה".

הפער בין החוקר לרופא
באופן גס, המטרה הראשונית של פפו, רוזנפלד ושותפיהם היא למקד את הכימותרפיה ולתחום את פעולתה. החומרים שמוזרמים לגוף במהלך טיפולי כימותרפיה, לא עושים כידוע איפה ואיפה. הם פוגעים בכל רקמות המטופל, גם הבריאות שבהן. הנוגדנים הזעירים, מקווים החוקרים, ישמשו כנהגי מוניות שיסיעו את חומרי הכימותרפיה לתוך התא הסרטני עצמו, וכך יחוסלו התאים החולים באופן סלקטיבי. כדי שזה יקרה יש צורך בהתאמה מושלמת, בהיקשרות אופטימלית בין הנוגדן לתא החולה, ופה מצוי האתגר.
כדי להבין איך זה עובד נשוב לטכניקה של חיסון הקורונה: החומר המוזרק לא חושף את הגוף לנגיף השלם, אלא רק ל־spike, חלבון המעטפת – ה"קוצים" שנמצאים על פני נגיף הקורונה והעניקו לו את שמו. המטרה היא שהמחוסן ייצר נוגדנים לחלבון הספציפי הזה, כי ברגע שהמערכת תוקפת את המעטפת, היא מנטרלת את הנגיף.
"על תאים של סרטן הערמונית יש מולקולה בשם PSMA. היא האנטיגן שמעורר ייצור נוגדנים", מסביר פפו. "המולקולה הזאת מבוטאת רק על התאים האלה. זהו סימן ההיכר של התא, הפנים שלו, הדבר הראשון שרואה מי שבא 'מבחוץ'. אנחנו הזרקנו לנאקה את המולקולה, ובתגובה הגוף שלה ייצר מיליוני נוגדנים. בשלב הזה אני צריך לזרוק חכה ולדוג את אלה שנקשרים בצורה החזקה ביותר למולקולה של הסרטן. וזה בדיוק מה שעשתה ליאור: היא ישבה וניסתה כל אחד מהנוגדנים על המטרה. כך נבחרו הננו־נוגדנים שלנו, שהם עצמם לא מזיקים לגוף. הודות לכך שהם מגיעים לתאים החולים ונצמדים אליהם, אני יכול להשתמש בהם לא רק להסעת הטיפול למקום הנכון, אלא גם לצורכי אבחון – אם אני אצבע את הנוגדנים בצבע פלורסנטי ואזריק אותם לחולה, אני אדע איפה בדיוק בגוף יושב הסרטן, איפה יש גרורות".
אני מבקשת מרוזנפלד להסביר לי איך נעשתה העבודה. "תחשבי שזאת ספרייה עצומה שבאותה נקודת זמן מכילה נוגדנים לא רק לחיסון, אלא לכל מה שהנאקה נחשפה אליו. זאת אומרת, אם הנאקה הייתה מצוננת יש לה נוגדנים לווירוס שהיא חטפה, ויש גם נוגדנים בעקבות מזון שהיא אכלה. מתוך המגוון העצום הזה של הנוגדנים, שאחוז די גדול ממנו לא קשור לסרטן, היינו צריכים לדלות את אלה שרלוונטיים לנו. ואז, מתוך אלה שאכן נקשרים ל־PSMA, הייתי צריכה לבדוק אילו נוגדנים עשו את זה בצורה הטובה ביותר. עד כאן עבדתי חצי שנה, ובסופה נשארתי עם ארבעה ננו־נוגדנים ביד. בשלב הבא רציתי לבדוק האם הם באמת הכי טובים – האם הם מזהים את 'חלבון המטרה' בסביבה רלוונטית ביולוגית, על גבי תאים של סרטן הערמונית, והאם הם פוגעים בתאים. בדקנו עד כמה הננו־נוגדנים נקשרים אל חלבון המטרה, והיכן על גביו מתרחש הקישור. גם למידע הזה יש משמעויות בפיתוח התרופה".
משם עברו החוקרים לבחון את הננו־נוגדנים על תאים סרטניים במעבדה. "בדקנו אם הם מזהים גידולים אנושיים. אחר כך לקחנו את הננו־נוגדן המוצלח ביותר, ואליו חיברנו את חומרי הכימותרפיה כך שישתחררו רק כשהם מגיעים לגידול ולא קודם. זו עבודה מאומצת מאוד. במשך כל הזמן הזה ייצרנו את החלבון במעבדה ושייפנו אותו לפי צרכינו. עבודה על דוקטורט עלולה להיות סיזיפית וקשה, אבל בסוף, כשהגענו לתוצאות שרצינו – אין מספק מזה. לעבוד על משהו ולראות אותו פועל בצורה יפה כל כך, זה דבר מדהים.
"המחקר שלנו צמח מצורך קליני. עסקנו בסוג מסוים של סרטן הערמונית, קבוצת גידולים שאין להם הרבה פתרונות ברמת הכימותרפיה. מה שאנחנו מציעים פה הוא הרחבה של מנעד התרופות, מעצם זה שאנחנו מורידים את מינון הכימותרפיה. ברגע שהיא קטנה באופן דרסטי – פוחתות משמעותית גם תופעות הלוואי הכל־כך קשות של הטיפול".
אחרי שסיימה את הדוקטורט, ובתזמון מושלם עם פרסום המחקר, החלה רוזנפלד (32) לעבוד כביולוגית מולקולרית בחברת Ukko, סטארט־אפ שעוסק במציאת טיפול לרגישויות למזון – "אבל אני עומדת בקשר רציף עם ניב פפו, ומתעדכנת במחקר. ביליתי במעבדה שלו מימי התואר הראשון ואפילו את בעלי הכרתי שם, הרבה לפני שהכרתי את ציפורה".
עיון קל בהיסטוריה של פפו – חתן פרס קלור, פרס קריל, פרס צ'ייר, פרס טורונטו ואחרים, והזוכה בשורה מרשימה של מענקים – מלמד שרבים ממחקריו התמקדו בסרטן הערמונית. בשנת 2015 למשל הוא זכה במענק היוקרתי של האיחוד האירופי (ERC) בשווי 1.65 מיליוני אירו, לצורך שלבי פיתוח סופיים של תרופה לסרטן הערמונית והלבלב. כעבור חמש שנים זכה במענק נוסף מאותה הקרן, לטובת המשך פיתוח קליני ומסחור התרופה, המבוססת על עיכוב חלבון שאחראי ליצירת גרורות.

כשאני שואלת את פפו למה דווקא סרטן הערמונית מתוך עשרות סוגי הסרטן הקיימים, הוא משיב שיש כמה סיבות. אחת מהן היא כמובן שכיחות המחלה, שנפוצה בקרב גברים מעל גיל חמישים; בישראל יש כ־10,000 גברים שבגופם אובחן סרטן חודרני של בלוטת הערמונית. שיעורי הריפוי אגב, גבוהים מאוד. "סיבה מרכזית נוספת היא שלפעמים התקצוב הוא זה שקובע לך מה תעשה. כדי לעבוד כאן אנחנו זקוקים למענקים, ואחד המענקים הראשונים שזכיתי בהם היה של קרן סרטן הערמונית – PCF".
בהקשר זה הוא מזכיר את השם מייקל רוברט מילקן – איש פיננסים יהודי־אמריקני שבמהלך שנות השבעים והשמונים היה לשם דבר בתחום אגרות החוב. ב־1990 הוא הורשע בשורה של עבירות מס ומרמה ונידון לעשר שנות מאסר, אבל שוחרר כעבור 22 חודשים בלבד. אחרי שחרורו חלה מילקן בסרטן הערמונית, והחל לנוע בין רופאים ומומחים שונים. הוא הצליח להחלים, ולאור מה שמצא בתחום – או ליתר דיוק לא מצא – ייסד את הקרן המוקדשת לחקר סרטן הערמונית.
"מילקן גייס חברים שלו, הצטרפו אליו אנשים נוספים, והיום הקרן הזו מממנת חוקרים שעוסקים בסרטן הערמונית. אף ישראלי לא קיבל לפניי את המענק הזה, ואני זוכר שכשהתקשרו אליי בלילה ובישרו לי על הזכייה, לא ידעתי איך לאכול את זה. מדובר במענק נפלא, ולא רק בגלל הכסף שמאפשר לי לחקור במעבדה. מדי שנה נפגשים בחסות הקרן כל חוקרי סרטן הערמונית, במסגרת הכנס הגדול בעולם שעוסק בנושא. שם אתה יכול לפגוש בעיקר רופאים.
"בדרך כלל יש פער גדול בינינו, חוקרי האקדמיה, לבין הרופאים: אנחנו לא כל כך יודעים מה הם רוצים, מה הם צריכים כדי לרפא, אילו תרופות הם מחפשים. בכנס החשוב הזה כולנו יושבים ביחד ושומעים זה את זה כדי לגשר על הפער בין שתי הדיסציפלינות. המפגשים האלה מאוד חיברו אותי לנושא. אז פחות או יותר התחלנו את הפרויקט עם הגמלים".
כשאין מה להפסיד
לא רק פרסים גרף פפו, אלא גם פוסט־דוקטורטים. אם בדרך כלל מקובל לעשות אחד ולמהר לתפוס משרה באקדמיה, לו יש שניים באמתחתו. "אני אוהב שקשה, שמאתגר, שצריך ללמוד הכול מהתחלה", הוא מסביר. "יכול להיות גם שלא הייתי סגור על מה אני רוצה לעשות כשאהיה גדול". את הפוסט־דוקטורט הראשון עשה במכון ויצמן, את השני באוניברסיטת סטנפורד, שנחשבת למֶכה של ההנדסה הגנטית – "ומה שאני עושה פה זה סוג של הנדסה גנטית. אני מהנדס נוגדן, שהוא למעשה חלבון גדול, משנה אותו ברמה הגנטית כדי שיתנהג כפי שאני רוצה. המחקרים שלי היום הם קומבינציה של כל מה שלמדתי: עבודה על חלבונים, פיתוח תרופות נגד סרטן, ופארמוקינטיקה – שזה תחום שבודק לא מה התרופות עושות לגוף, אלא מה הגוף עושה לתרופות. איך הוא קולט ומפנה אותן, תוך כמה זמן וכן הלאה".
באיזה שלב אתם נמצאים מול חברת התרופות?
"אנחנו בשלב החתימות. מה שחשוב לנו הוא שבחברה יש רופא־חוקר, ומתוקף תפקידו הוא יכול לנסות את התרופה בקליניקה. זה יתרון גדול. יש בחברה גם קבוצת מחקר שיכולה לעשות שינויים בננו־נוגדן שיצרתי, להתאים אותו לצרכים שלה, ומיד לבדוק את זה על חולים. עצוב לי לומר, אבל לרפואה אין מה להציע לחלק מהחולים בשלב מתקדם, ולכן אין להם מה להפסיד. בחברות האלה נחסכת דרך ארוכה של רגולציה; מה שרופא של החברה יכול לעשות בקליניקה, אני הייתי יכול לעשות רק כעבור שנים. בשימוש בנוגדן לצורך אבחון, למשל, הזרקת החומר היא בכמויות קטנות מאוד, החומר לא רעיל, ולכן אין כל נזק. כך אפשר לנסות אותו על חולים אמיתיים, ולא על חיות מעבדה".
השימוש בננו־נוגדנים הוא תחום חדש לגמרי, מוסיף פפו. "זה עניין של כמה שנים, ואין כמעט חברות שמתעסקות בזה. יש חברה בלגית שהיא פחות או יותר היחידה שפועלת בתחום הננו־נוגדנים באופן משמעותי. אני כחוקר לא מחפש לעשות משהו שכולם עושים, ובטח לא מה שחברות הענק עושות. לכן מבחינתי זה הזמן להיכנס לתחום. כמובן, יש בזה סיכון – חברות התרופות אוהבות להסתכל רק על מה שמתחת לפנס, ומחפשות דברים שכבר עובדים ומוכחים. על נוגדנים הן בהחלט מוכנות לשמוע, אבל ננו־נוגדנים זה חדש מדי בשבילן, לא בטוח שפיתוח כזה יעבוד. אני לעומת זאת יכול להרשות לעצמי להסתכן, כי יש לי גב אקדמי. לי לא יקרה שום דבר אם לא אמצא את תרופת הפלא. מצד שני, יש סיכוי שזה כן יקרה. וגם אם לא, יש סיכוי שהמאמר שלי ישרת את הבאים אחריי, והמחקר יהפוך ליישומי".
ד"ר רוזנפלד: "הנוגדנים ששלפנו הם ספרייה עצומה שבאותה נקודת זמן מכילה נוגדנים לא רק לחיסון, אלא לכל מה שהנאקה נחשפה אליו – לווירוס שהיא חטפה, למזון שהיא אכלה. מתוך המגוון העצום הזה של הנוגדנים, היינו צריכים לדלות את אלה שרלוונטיים לנו. אחרי חצי שנה של עבודה, נשארתי עם ארבעה ננו־נוגדנים ביד"
פפו מדגיש כי העניין הוא לא רק התוצר הסופי, אלא הטכנולוגיה עצמה: "את השיטה שפיתחנו אני יכול ליישם באמצעות נוגדנים אחרים שנמצא". המעבדה שלו, הוא מספר, כבר רותמת את הפיתוח לטיפול במחלות שונות לגמרי מסרטן. "השתמשנו בשיטה הזו גם בפרקינסון ובאלצהיימר, שהן מחלות של מערכת העצבים. במוחם של החולים נוצרים צברים של חלבונים, פסולת שלא מפונה. כדי למצוא תרופה למחלות האלה, אנחנו עושים שוב אותו דבר – מהנדסים חלבונים שידעו להיקשר היטב לצברים הרעילים ולפרק אותם, וכך למעשה אפשר יהיה לרפא מחלות ניווניות. בנושא הזה אנחנו כבר בשלב של ניסויים בבעלי חיים.

ייסד את הקרן לחקר סרטן הערמונית. מילקן
צילום: יעל (פרוינד) אברהם
"יש לנו שיתוף פעולה יפה מאוד עם קבוצה באוניברסיטה שלנו שמתעסקת באוסטאופורוזיס – תופעה שמתרחשת מעל גיל מסוים, כאשר תאים אוסטאוקלסטיים פוגשים את העצם ומפרקים אותה. מי שמושך אותם להיקשר אל העצם הן מולקולות שנמצאות על התאים, בדומה ל־PSMA שלנו. אנחנו פועלים באותה טכניקה: יוצרים חלבונים שיודעים להתחבר למולקולות האלה, מעכבים את הקישור, וכך דלדול העצם נמנע. גם זה נוסה כבר בחיות מודל, ופרסמנו את התוצאות בכתב־עת חשוב".
צלצול טלפון קוטע את שיחתנו. שאלה דחופה לגבי פוסט־דוקטורנט קרואטי, שהגעתו מתעכבת בגלל הקורונה. אני תוהה אחר כך באוזני פפו אם חקר הסרטן נפגע בשנה האחרונה, ולא רק בגלל השמיים הסגורים: המשאבים הכלכליים שהושקעו בקורונה הם אדירים, ונדמה כאילו היא ניקזה אליה את כל התקציבים. "קצת מוקדם לדעת בנקודת הזמן הזאת אם מחקרי הסרטן נפגעו, אבל אני חושב שכן, בקנה מידה קטן", הוא אומר. "ראיתי בזמן האחרון הרבה מאוד 'קולות קוראים' שמציעים מימון למחקרים שקשורים לקורונה, וזה כמובן בא על חשבון דברים אחרים. בימים כתיקונם יש הרבה מאוד כסף בחקר הסרטן – ויש גם המון קבוצות שמתעסקות במחקר. אבל בניגוד למחלה כמו קורונה, בסרטן יש סוגים רבים מאוד, ואנחנו רואים מנגנונים שונים של עמידות, תאים ש'זורקים' את התרופות החוצה. כך שיש המון מענקים, אבל הם מתחלקים בין הרבה מאוד תחומים. יש סוגי סרטן שהם קטלניים מאוד ועדיין אין לנו מענה בשבילם, לצד סוגים שבהם אנחנו רואים אחוזי ריפוי גבוהים".
פפו מתגורר ברעננה עם אשתו נילי – מנהלת אשכול גנים בתל־אביב – ושלושת ילדיהם. לקראת סוף השיחה אני שואלת אותו על פשר הבחירה באוניברסיטה מרוחקת מאזור המרכז. "רציתי להיות כאן בבאר־שבע קודם כול בגלל האווירה. יש באוניברסיטה הזו משהו שונה ממוסדות אחרים שלמדתי בהם. מעבר לזה, בית החולים סורוקה נמצא כאן ממש מעבר לכביש, והקִרבה מאפשרת לנו לקיים שיתופי פעולה חשובים. כמי שעובד על פיתוח תרופות, אני חייב בית חולים.
"יחד עם הקרדיולוג פרופ' יורם עציון, למשל, אני עובד על פרויקט מעניין שקשור בהתקפי לב, ומבוסס על אותו עיקרון של מחקר הגמלים. בהתקפי לב יש חלבון שמופרש וגורם לצלקות. הוא יוצר נזק, מעין פקמן שאוכל את הסביבה של התאים. אנחנו מייצרים חלבונים שנקשרים לחלבון הזה וחוסמים אותו. מכיוון שעציון הוא רופא־חוקר בסורוקה, אפשר לבדוק את השיטה על חולים. זה היה חשוב לי. ומעבר לכך, יש בפריפריה משהו נהדר, מוריד לחץ. יש כאן הון אנושי".
לתגובות: dyokan@makorrishon.co.il